Concentração em quantidade de matéria (molaridade)
A molaridade conhecida também como concentração em quantidade de matéria, concentração molar ou concentração em Mol/L (mol por litro) é a relação entre a quantidade de substância dissolvida ou diluída (soluto) em dada matéria que permite a dispersão do soluto em seu meio (solvente). Na União Internacional de Química Pura e Aplicada (IUPAC) foi decido que o correto a ser utilizado é Concentração em Mol/L ou Concentração em quantidade de matéria, sendo assim o recomendado no Sistema Internacional de Unidades (SI) tais nomenclaturas.
IMPORTÂNCIA DA MOLARIDADE
A concentração em mol/L é muito importante quando se trabalha em laboratórios ou em indústrias, pois permite identificar quantos mols existem de soluto dentro de um litro de certa solução. O mol é igual ao número correspondente a constante de Avogadro, que equivale a 6,02x1023 (seiscentos e dois sextilhões), então quando alguém diz em um litro de uma solução tem um mol de soluto está a dizer que tem 6,02x1023 de átomos dissolvidos.
COMO CALCULAR
A fórmula da molaridade é:
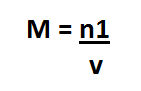
Onde M= Concentração em quantidade de matéria (molaridade)
n1= número de mols do soluto, sendo que a grandeza 1 significa que se refere ao soluto
v= volume da solução, dada em Litros (L)
Quando se trabalha em laboratórios geralmente no frasco do composto utilizado não consta o número de mols, porém contém a informação da Massa Molecular (M1) que indica quantas gramas são necessárias para se ter um mol. Sabendo disso tendo a massa molecular basta realizar uma "adaptação" da seguinte forma:
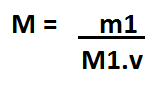
Ficando Molaridade igual a m1 (massa do soluto EM GRAMAS) divido por M1 (massa molecular do soluto), vezes o volume da solução (EM LITROS) . Essa "adaptação" foi realizada pois para se achar n1 (número de mols do soluto) temos que dividir a massa da amostra utilizada pela sua própria massa molecular (que consta no frasco), sendo assim é descoberto n1, porém como na fórmula "original" o n1 é dividido pelo volume, se multiplica o M1 pelo volume.
ATIVIDADES RESOLVIDAS (EXEMPLOS)
1. Qual a molaridade uma solução composta de 10 g de glicose (C6H12O6) em 2 litros de solução?
A questão acima não foi informado a massa molecular porém consta que uma molécula de glicose contém seis átomos de carbono (C6), doze hidrogenios (H12) e seis oxigênios (H6), devido uma molécula equivaler a um mol podemos multiplicar a quantidade de vezes que cada átomo de dado elemento se repete por sua respectiva massa obtendo assim o valor de um mol, para maior compreendimento veja a seguir a representação do cálculo do equivalente mol de uma molécula de glicose:

Sendo assim os dados obtidos são respectivamente:
m1: 10 gramas
M1= 180 gramas (massa molecular de um mol)
V= 2 litros
M = ? ( falta molaridade)
Colocando os dados na fórmula fica da seguinte forma:
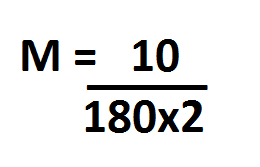
Após multiplicar o 180 por 2, ficará da seguinte forma:
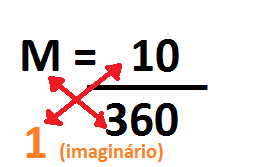
Basta em seguida multiplicar cruzado, lembrando que abaixo do M é como se existisse o número um, resultando em:
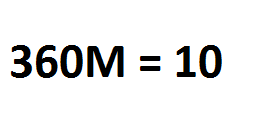
Posteriormente basta jogar o 360 para o outro lado, dividindo por 10, obtendo como resultado aproximadamente 0,027777778 mol/L, que pode ser arredondado para 0,028 mol/ L (lê-se mol por litro), exemplo abaixo:

30/11/2014 - Ariquemes-RO
Mauricio Jonas Weirich Urban
Graduado em Química - Licenciatura