Balanceamento de reações químicas (equações) - método por tentativa
A lei da Conservação de Massas de Lavoisier informa que "na natureza nada se perde, nada se cria, tudo se transforma", baseando-se nela é utilizado o cálculo estequiométrico em reações químicas para balanceá-las, pois em toda reação química não se perde nem se cria átomos, devido tal fato é necessário igualar os números deles entre reagentes e os produtos.
CONCEITO DO BALANCEAMENTO
Antes de iniciar o processo de cálculo estequiométrico de reações químicos primeiramente é necessário compreender o que é uma reação química, veja o exemplo a seguir em que o gás hidrogênio (H2) reage com o oxigênio (O2):
H2 + O2 (Reagentes) = H2O + O (Produtos)

Fonte da imagem: https://www.cdcc.usp.br/quimica/fundamentos/equacoes.html
Na imagem acima pode ser observado que na reação entre os gases hidrogênio (H2) e oxigênio (O2) (reagentes) gerou como produto água (H2O) e sobrou um átomo de oxigênio, sendo necessário balancear devido a equação não está completa, pois seguindo a Lei da Conservação de Massas é necessário que a mesma quantidade de átomos presentes nos reagentes também esteja presentes no produto da reação química, para resolver o "problema" basta dobrar o número de hidrogênios adicionando o coeficiente estequiométrico 2. O coeficiente estequiométrico é o número que vem antes de cada molécula (acompanha) em uma reação química que tem por função indicar a quantidade de vezes que a molécula se repete. Após dublicar o número de moléculas de H2 terá como resultado também duas 2 moléculas de H2O, então basta colocar o dois da mesma forma no produto, ficando então a equação balanceada através do método por tentativa da seguinte forma:
2 (adicionado) H2 + O2 = 2 (adicionado) H20
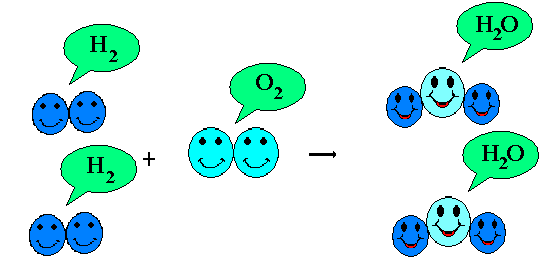
Fonte da imagem: https://www.cdcc.usp.br/quimica/fundamentos/equacoes.html
BALANCEAMENTO DE EQUAÇÕES
Para maior compreendimento referente ao tema, abaixo será mostrado um exemplo de reação entre o ácido fosfórico (H3PO4) e a base hidróxido de prata (AgOH) em que ocorre a formação de água + (mais) sal, veja o exemplo passo a passo:
H3PO4 + AgOH (REAGENTES) ------(gera)-----> 3H2O + Ag3PO4 (PRODUTOS)
1º Acima foi verificado que os átomos de fósfaro (P) já estão balanceados, pois aparecem uma vez nos reagentes e uma vez nos produtos, sendo assim será colocado como coeficiente esquiométrico o número 1 para ambas moléculas em que o fósfaro está presente:
1 H3PO4 + AgOH (REAGENTES) ------(gera)-----> 3H2O + 1 Ag3PO4 (PRODUTOS)
2º Em seguida foi verificado que os átomos de prata (Ag) aparecem três vezes em uma mólecula dos produtos, por isso foi colocado o coeficiente 3 na molécula do reagente em que o Ag está presente:
1 H3PO4 + 3 AgOH (REAGENTES) ------(gera)-----> 3H2O + 1 Ag3PO4 (PRODUTOS)
*OBSERVAÇÃO: Na primeira molécula dos produtos o coefiente três está também para o oxigênio, ocasionando três átomos de Oxigênio.
3º Ocorreu que o átomos de oxigênio (O) já ficaram balanceados, contendo sete átomos nos reagentes e sete nos produtos.
O BALANCEAMENTO DA REAÇÃO:
H3PO4 + AgOH (REAGENTES) ------(gera)-----> 3H2O + Ag3PO4 (PRODUTOS)
É: 1 H3PO4 + 3 AgOH -----------> 3H2O + 1 Ag3PO4
A equação ficou balanceado gerando como produtos três moléculas de água (3 H2O) e uma molécula do sal fosfato de prata (1 Ag3PO4).
25/11/2014 - Ariquemes-RO
Mauricio Jonas Weirich Urban
Graduado em Química - Licenciatura
